Maladie d'Alzheimer et démences apparentées (MAAD)
Projet collaboratif et formulaire pour poster vos questions et/ou vos commentaires
Ce wiki est un projet collaboratif, auquel chacun peut apporter sa pierre, soit par les questions issues de sa pratique pour lesquelles les réponses sont incertaines ou absentes, soit par les réponses qu'il souhaite lui-même apporter.
Vous devez pour cela vous entrer votre question ou votre commentaire en utilisant notre formulaire en ligne ici...
Quelle est la fréquence de la maladie d’Alzheimer et des démences apparentées ?
Parmi les maladies neurodégénératives, la maladie d’Alzheimer et démences apparentées (MAAD) occupe la première place en termes de fréquence [1].
L’incidence de la démence augmente fortement avec l’âge et, en raison de l’augmentation de l’espérance de vie, le nombre de cas devrait augmenter considérablement avec le temps [2].
La source essentielle des données épidémiologiques françaises sur la maladie d’Alzheimer vient de l’étude PAQUID réalisée en Aquitaine depuis 1989 [3]. C’est une cohorte prospective en population générale de personnes âgées de 65 ans et plus vivant au domicile et tirées au sort à partir des populations de 75 communes de Gironde et de Dordogne. La structure par âge et sexe de cette sous population peut être considérée comme semblable à celle de la population française.
Rare avant 65 ans, après cet âge la fréquence de la maladie s’élève à 2 à 4% de la population générale et augmente rapidement pour atteindre 15% de la population à 80 ans [4]. On estime ainsi que 900 000 personnes souffrent de la maladie d’Alzheimer en France. Compte tenu de l’augmentation de l’espérance de vie on devrait atteindre 1,3 millions en 2020 [4].
À partir de projections démographiques nationales en supposant que l'espérance de vie augmentera de 3,5 ans pour les hommes et de 2,8 ans pour les femmes d'ici 2030, le nombre de sujets atteints de démence devrait augmenter d'environ 75% entre 2010 et 2030, avec une augmentation de 200% après 90 ans [2].
Selon les données du Système national d’information inter-régimes de l’Assurance maladie (Sniiram) qui représentent un outil possible pour la surveillance épidémiologique de la maladie d’Alzheimer et autres démences (MAAD) 524 770 cas prévalents de MAAD ont été identifiés fin 2014 (Taux=2,2%, 2,9% chez les femmes et 1,5% chez les hommes). Après l’âge de 70 ans, les estimations de prévalence obtenues dans le Sniiram sont en moyenne 1,6 fois inférieures à celles attendues par rapport à l’étude PAQUID (8,1% versus 12,1%) [1].
Même s’il subsiste une incertitude liée au peu de données disponibles chez les plus âgés, l’accroissement de la prévalence de la maladie d’Alzheimer est une tendance « lourde » plus que probable dont les enjeux sont majeurs [5].
Références
[2] Jacqmin-Gadda H, Alperovitch A, Montlahuc C, Commenges D, Leffondre K, Dufouil C, et al. 20-Year prevalence projections for dementia and impact of preventive policy about risk factors. Eur J Epidemiol. 2013;28(6):493-502.
Qualité de la preuve : Niveau 3
Mots clés : maladie d’Alzheimer ; épidémiologie [alzheimer disease ; epidemiology]
Quelle est l’influence de l’âge sur le développement de la maladie d’Alzheimer ?
Au vu des données disponibles la prévalence de la maladie d’Alzheimer augmente de façon linéaire avec le vieillissement avec des variations en fonction du genre [1].
Selon les données d’une étude coopérative européenne [1,2] entre 65/69 ans, 80/84 ans et 90 ans et plus :
- La prévalence (nombre de cas connus dans une population à un moment donné) passe :
- De 1,6% à 11% et 22,1% chez l’homme et de 1% à 12,6% et 30,8% chez la femme pour les démences.
- De 0,6 à 6,3 et 17,7% chez l’homme et de 0,7 à 8,4 et 23,6% chez la femme pour la maladie d’Alzheimer
- De 0,5 à 2,4 et 3,6% chez l’homme et de 0,1 à 2,3 et 5,8% chez la femme pour les démences mixtes
- L’incidence (nombre de nouveaux cas sur une période donnée) pour 1000 personnes-années passe :
- De 2,4% à 27,6% et 40,1% chez l’homme et de 2,5% à 34,1% et 81,7% chez la femme pour les démences.
- De 0,9% à 14,8% et 20% chez l’homme et de 2,2% à 27,3% et 69,7% chez la femme pour la maladie d’Alzheimer.
- De 1,2% à 8,3% et 10,9% chez l’homme et de 0,3% à 4,5% et 7% chez la femme pour les démences mixtes
Ainsi les taux de prévalence de la maladie d’Alzheimer augmentent rapidement avec l’âge.
Le sex-ratio hommes/femmes varie également en fonction de l’âge, le taux de prévalence étant supérieur chez les hommes avant 70 ans puis chez les femmes après cet âge : sex-ratio =1,29 (IC 95% = 1,27-1,31) avant 70 ans vs 0,74 (0,73-0,75) après 70 ans (p <0,0001) [2].
Mais ces données doivent être interprétées avec prudence. Plusieurs études montrent une absence de corrélation stricte entre le degré d’atteinte cognitive et l’importance des lésions neurologiques observées à l’imagerie. Des centenaires peuvent présenter des anomalies neuropathologiques importantes sans trouble cognitif et inversement des sujets plus jeunes peuvent présenter des troubles cognitifs importants sans lésion neuropathologique décelable [1,2].
Références
Qualité de la preuve : Niveau 3
Mots clés : maladie d’Alzheimer ; distribution en fonction de l’âge [alzheimer disease ; age distribution].
La maladie d’Alzheimer peut-elle être héréditaire ?
On distingue deux formes de la maladie d’Alzheimer : la forme sporadique, la plus répandue chez les personnes âgées et la forme héréditaire beaucoup plus rare.
Les formes héréditaires représentent 1,5% à 2% des cas. Elles se déclarent presque toujours avant 65 ans, souvent autour de 45 ans.
10% des cas avant 65 ans concernent des formes familiales rares de la maladie.
Dans la moitié de ces cas, des mutations rares à l’origine de la maladie ont pu être identifiées [1].
La susceptibilité individuelle à la maladie possède aussi une composante génétique, puisque le risque de développer la maladie est en moyenne multiplié par 1,5 si un parent du premier degré est touché, et par 2 si au moins deux le sont.
Le début précoce de la maladie (avant 60 ans) suggère la forme précoce autosomique dominante et nécessite un arbre généalogique précis. Le conseil génétique doit être proposé aux familles concernées [2].
Références
Qualité de la preuve : Niveau 3
Mots clés : maladie d’Alzheimer ; hérédité [alzheimer disease ; heredity].
Peut-on identifier des facteurs de risques de développer une maladie d’Alzheimer ?
Des facteurs liés au mode de vie peuvent réduire ou augmenter le risque de développer une démence.
Le diagnostic de démence est souvent retardé en raison d'une croyance erronée qu’il s’agit d’une conséquence naturelle du vieillissement ou en raison de la réticence d'une personne à demander de l'aide à propos de ses problèmes de mémoire.
Bien que les signes de démence se manifestent assez tard dans la vie des troubles pathologiques cérébraux cliniquement silencieux se développent plusieurs années auparavant [1,2].
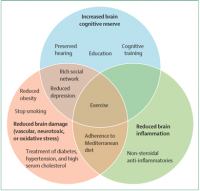
En incorporant des facteurs de risque potentiellement réversibles à différentes phases de la vie et pas seulement de la vieillesse, la « Commission du Lancet sur la prévention, l'intervention et les soins de la démence » [1] a calculé que plus d'un tiers des cas de démence pourraient théoriquement être évitables.
Une augmentation de l'éducation et de l'exercice durant l'enfance, le maintien de l'engagement social, la réduction ou l'arrêt du tabagisme et la gestion de la perte auditive, de la dépression, du diabète, de l'hypertension et de l'obésité sont des facteurs de risque qui affectent le cerveau et pourraient tous contribuer à la prévention ou au retard de la démence.
Bien que l’intervention sur un certain nombre de facteurs de risque modifiables, notamment l’isolement social et la baisse de l’audition, ait un effet positif sur la prévention de la démence [2] l’âge reste le principal facteur de risque non modifiable.
Références.
Qualité de la preuve : Niveau 3
Mots clés : maladie d’Alzheimer ; démence ; population à risque ; prévention [alzheimer disease ; dementia ; factor, risk ; prevention].
Peut-il y avoir un lien entre la pollution atmosphérique et le risque de démence ?
La pollution atmosphérique est connue de longue date comme associée à un risque accru de maladies respiratoires et de cancers [1] puis comme un facteur de risque de maladie cardiovasculaire [2]. Plus récemment, la pollution atmosphérique a été reconnue comme un facteur de risque de démence.
Une revue systématique de la littérature a recherché et analysé les études longitudinales portant sur la pollution atmosphérique, la démence et le déclin cognitif [3]. Les principaux composants de la pollution atmosphérique étudiés pour leur impact sur la santé sont gazeux et particulaires. Les gaz sont essentiellement les oxydes d’azote (NOx) comportant le dioxyde d’azote (CO2) et le monoxyde d’azote (CO), le dioxyde de souffre (SO2) et l’ozone. Des composés organiques volatiles et semi-volatiles sont également incriminés.
Le second type de composants est représenté par les particules classées par leur taille : PM (particule matter) : PM 10 (diamètre < 10 µm et ≥ 2,5 µm), PM 2,5 (2,5µm > diamètre > 0,1 µm) et les nanoparticules <0,1 µm).
Dans les agglomérations, les moteurs diesel représentent 30 à 40% des émissions de particules et plus de 60% des émissions de NO2. Dans les campagnes, la combustion du bois de chauffage représente une importante source de particules.
Dans 13 publications de cette méta-analyse portant sur des populations des États-Unis, du Canada, de Taïwan, de Suède et du Royaume Uni, le NO2, le NOx, le CO et l’ozone, les résultats montrent qu’une plus grande exposition aux PM2,5, NO2/NOx et au CO était associée à une augmentation du risque de démence.
Le lien entre exposition à la pollution et aux déclins cognitifs était moins évident.
Mais les données de cette méta-analyse présentent une grande hétérogénéité des critères diagnostiques des démences et des critères d’exposition à la pollution et les études utilisaient des méthodologies différentes pour sélectionner les populations étudiées, l’évaluation de l’exposition à la pollution et les tests diagnostiques de la cognition.
Dans ces études de faible niveau de preuve l'exposition à long terme à la pollution atmosphérique semble associée à un risque plus élevé de démence.
Références
[2]. Ruidavets JB, Ferrières J. Atmospheric pollution: a cardiovascular risk factor. Sang Thrombose Vaisseaux. 2007;19(9):487-491. doi:10.1684/stv.2007.0200.
Qualité de la preuve : niveau 3
Mots clés : pollution de l’air ; démence [air pollution ; dementia]
Quels liens entre l’hypertension artérielle et le risque de démence et de maladie d’Alzheimer ?
Des facteurs de risque cardiovasculaires (diabète, hypertension, hyperlipidémie) non pris en charge à l’âge moyen de la vie sont associés à une survenue plus fréquente de la maladie, sans que l’on sache encore par quels mécanismes [1].
Plusieurs études épidémiologiques ont rapporté une relation apparente entre une élévation de la pression artérielle à un âge moyen (entre 40 et 64 ans) et l’apparition de troubles cognitifs et de maladie d’Alzheimer à un âge plus avancé après 65 ans. Cet effet serait plus marqué si l’hypertension n’est pas traitée [2].
D’autre études ont montré un lien entre l’hypertension à l’âge moyen et le risque de démence vasculaire mais pas avec la maladie d’Alzheimer [2].
L'hypotension artérielle en fin de vie a été associée de manière plus cohérente aux troubles cognitifs et à la démence [2].
Les liens entre la pression artérielle, les troubles cognitifs et la démence sont complexes et pas formellement établis [2, 3].
Références
Qualité de la preuve : Niveau 3
Mots clés : maladie d’Alzheimer ; démence ; hypertension artérielle [alzheimer disease ; dementia ; high blood pressure].
Y aurait-il un lien entre pollution atmosphérique, risque cardiovasculaire et risque de démence ?
Une étude suédoise a évalué l’incidence des démences et leur relation avec deux principaux polluants atmosphériques (particules de 2,5 µm [PM2,5] et oxyde d'azote [NOx]) et les maladies cardiovasculaires (MCV).
2927 personnes âgées de 60 ans et plus (âge moyen 74, 1 ans ; 63,0% de femmes) au sein de l’agglomération de Stokholm [1] qui n'avaient pas de démence au départ et vivant à domicile ou en institution, ont été suivies en moyenne 6,1 années.
Les MCV étudiées étaient la fibrillation auriculaire, les cardiopathies ischémiques, l’insuffisance cardiaque et les accidents vasculaire cérébraux. Trois cent soixante-quatre participants atteints de démence incidente ont été identifiés. Deux types de relations ont été étudiées :
- Relation entre niveau de pollution et démence:
- Pour les PM2,5 : rapport de risque [HR] pour une différence de 0,88 µg /m3 : 1,54 (IC 95%, 1,33-1,78);
- Pour le NOx : HR pour une différence de 8,35 µg / m3 NOx, 1,14 (1,01-1,29).
- Relation entre les maladies cardiovasculaires et une augmentation du risque de démence:
- L’Insuffisance cardiaque : HR 1,93 (1,54-2,43) et 1,43 (1,17-1,75) respectivement pour PM2, pour NOx,
- et les cardiopathies ischémiques (HR 1,67 [1,32-2,12] et 1,36 [1,07-1,71] pour PM 2,5 et pour les NOx) qui elles-mêmes voient leur incidence augmenter avec le niveau de pollution
D’autres études, dont une au Canada, dans la province de l’Ontario, ont retrouvé la même association entre pollution atmosphérique relevée près d’axes routiers et démence [2,3].
Il n’a pas été mis en évidence d’association entre pollution atmosphérique, Maladie De Parkinson et Sclérose en plaque [4].
Parmi les phénomènes physiopathologies retenus, les démences vasculaires semblent représenter environ la moitié des causes. Une toxicité directe des particules fines, au niveau du bulbe olfactif pourrait être une cause [5].
Références
Qualité de la preuve : niveau 3
Mots clés : pollution de l’air ; démence [air pollution ; dementia]
Quel effet d’un traitement antihypertenseur sur l’évolution de la maladie d’Alzheimer ?
Certaines études ont démontré que les médicaments antihypertenseurs pourraient réduire le risque de maladie d’Alzheimer mais les résultats des études sont très hétérogènes.
Une revue systématique de 4 essais a inclus 15 936 patients hypertendus (âge moyen 75,4 ans). La pression artérielle moyenne au début de l’étude était de 171 / 86 mm Hg [1]. Les résultats n’ont montré aucune différence significative entre le traitement (236 / 7767) et le placebo (259 / 7760) (OR 0,89 ; 0,74-1,07) avec une hétérogénéité importante entre les résultats [1].
Dans les trois essais faisant état d’une modification du score au MMSE les niveaux de pression artérielle systolique et diastolique étaient réduits de manière significative: différence moyenne pondérée - 10,22 (- 10,78 à – 9,66) pour la pression artérielle systolique (PAS) et – 4,28 ( - 4,58 à – 3,98) pour la pression artérielle diastolique (PAD), sans aucune différence du MMSE.
Un essai contrôlé randomisé sur 102 sites différents aux États-Unis et à Porto Rico chez des adultes âgés de 50 ans ou plus [2] a évalué l’effet d’un contrôle intensif de la pression artérielle (objectif de pression artérielle systolique [PAS] < 120 mm HG) comparativement à un objectif de PAS < 140 mm Hg sur le risque d’évolution d’une démence, sur 9361 participants (âge moyen 67,9 ans) dont 3332 femmes (35,6 %). Tous avaient à la base un score global d’évaluation cognitive (MoCA score) médian de 23 (écart interquartile 20-26).
La pression artérielle systolique moyenne était de 121,6 mm/Hg (IC 95% : 120,8-122,3) et 134, 8 mm/Hg (134,1-135,6) respectivement dans les groupes traitement intensif (TI) et traitement standard (TS).
Sur une période de suivi de 5 ans :
- 149 participants (7,2 personnes/ années) et 176 participants (8,6 P/A) ont présenté des signes de démence probable respectivement dans les groupes TI et TS (Rapport de Hasard [HR] 0,83 ; 0,67-1, 04).
- 287 et 353 participants (14,6 vs 18,3 P/A) ont présenté des signes de déficit cognitif léger (MCI) respectivement dans chaque groupe TI et TS (HR 0,81 ; 0,69-0,95).
Un objectif de pression artérielle systolique < 120 mm /Hg comparativement à un objectif < 140 mm/Hg ne réduit pas de façon significative l’incidence de la démence [2]. Il n'y a aucune preuve convaincante provenant d'essais contrôlés randomisés que la baisse de la pression artérielle en fin de vie empêche le développement de troubles cognitifs et de démence chez les patients sans maladie cérébrovasculaire antérieure apparente [1].
Références
Qualité de la preuve : Niveau 3
Mots clés : maladie d’Alzheimer ; démence ; hypertension artérielle [alzheimer disease ; dementia ; high blood pressure].
Un mode de vie sain peut-il être associé à un risque moindre de démence ?
Chez les personnes à faible risque génétique un mode de vie sain est associé à un plus faible risque de démence.
Dans une vaste étude de cohorte rétrospective de 500 000 personnes ayant fréquenté 22 centres d’évaluation au Royaume Uni entre 2006 et 2010, 193 383 participants > 60 ans pour lesquels on disposait d’un résultat d’enquête génétique ont été inclus pour déterminer si un mode de vie sain sans risque génétique était associé à un risque moindre de démence [1].
Un mode de vie sain était défini à partir de 4 critères sur la base des recommandations internationales :
- Statut tabagique actuel, antérieur, jamais
- Activité physique régulière : au moins 150 mn d’AP modérée ou 75 mn d’AP intense par semaine
- Alimentation comportant au moins 4 des 7 groupes d’aliments recommandés comme prioritaires sur le plan cardio-métabolique (fruits, légumes, poisson, viandes transformées ≤ 1 portion/ semaine, viandes rouges non transformées ≤ 1,5 portion par semaine, céréales entières ≥ 3 portions / jour et céréales raffinées ≤ 1,5 portion / jour.
- Alcool, des études ayant montré une courbe en U avec un risque moindre de démence associé à une consommation modérée > 0 et < 14 g/jour chez la femme et > 0 et < 28 g/jour chez l’homme.
Sur 1 545 433 personnes/année de suivi 68, 1%, 23,6% et 8,2% étaient considérées respectivement comme ayant un mode de vie favorable, intermédiaire ou non favorable.
Le risque de démence augmente de façon régulière en fonction du risque génétique de 0,63% (0,56-0,71) à 1,23% (1,13 – 1,15) respectivement pour les patients à faible risque génétique et risque élevé (HR 1,34 ; 1,15-1,57).
Le risque augmente également régulièrement de 0,82% (0,77-0,87) à 1,16% (1,01-1,34) en fonction du mode de vie respectivement favorable et non favorable (HR : 1,35 ; &,15-1,58).
Le risque de développer une démence passe de 0,56 % (0,48-0,66) en cas de faible risque génétique associé à un mode de vie favorable à 1,78% (1,38-2,28) en cas de risque génétique élevé + mode de vie défavorable. Mais il n’y a pas d’interaction significative indiquant une influence du mode vie sur du risque génétique.
Référence:
Qualité de la preuve : Niveau 3
Mots clés : maladie d’Alzheimer ; mode de vie [alzheimer disease ; life style].
Quel est le lien entre la consommation d’alcool et le risque de déclin cognitif chez les personnes âgées ?
L’association de la consommation d’alcool et de la survenue de démence semble différer selon l’existence ou non à la base de troubles cognitifs (Mild Cognitive Impairment – MCI) et la quantité d’alcool.
Dans une étude de cohorte [1] sur 3021 participants (âge médian 78 ans ; intervalle interquartile 76-80 ; 46,2% de femmes) sur un suivi médian de 6 ans (4,9-6,5) 512 cas de démence sont survenus.
Pour 7,1 à 14,0 verres / semaine comparativement à moins de 1,0 verre/semaine, les rapports de risque de démence (RR) étaient de 0,63 (0,38-1,06) chez 2548 participants sans MCI et de 0,93 chez 473 participants avec MCI. Pour plus de 14 verres/semaine le RR était de 1,72 (0,87-3,40).
Parmi les participants sans MCI, la consommation quotidienne de petites quantités d'alcool était associée à un risque moindre de démence comparativement à une consommation d'alcool fréquente plus élevée (RR 0,45 ; 0,23 - 0,89 ; p = 0,02) quel que soit le sexe, l’âge ou le génotype APOE E4. Des études ont montré une courbe en U avec un risque moindre de démence associé à une consommation modérée > 0 et < 14 g/jour chez la femme et > 0 et < 28 g/jour chez l’homme. Le « nadir » (point le plus bas de la courbe) correspondant à 4 verres/ semaine [2].
Comparativement à la consommation de moins de 1 verre/semaine l’abstinence totale chez les patients sans MCI et la consommation de plus de 14,0 verres/semaine chez ceux avec MCI étaient associées à de moins bons résultats aux scores d’évaluation neuropsychologique par rapport à l’évaluation de base, respectivement - 0,46 point (- 0,87 à – 0,04) et – 3,51 points ( - 5,75 à – 1,27).
Chez les patients présentant des troubles cognitifs, la consommation de plus de 14,0 verres par semaine est associée à un risque de déclin cognitif plus sévère par rapport aux consommateurs de moins de 1,0 verre par semaine.
L’abstinence complète et la consommation de plus de 14 verres/ semaine sont associées à de moins bons scores cognitifs chez les personnes âgées. Il est important d’évaluer soigneusement leur comportement de consommation d'alcool.
La réduction du risque de démence passe par la promotion d’une alimentation saine et équilibrée et des actions spécifiques concernant l’usage nocif d’alcool [3].
Références:
Qualité de la preuve : Niveau 3
Mots clés : maladie d’Alzheimer ; démence ; alcool [alzheimer disease ; dementia ; alcohol].
Quel bénéfice d’un dépistage systématique en soins primaires d’une déficience cognitive chez les personnes âgées ?
Le fait de diagnostiquer la maladie dès ses premiers signes permet à la personne malade de choisir une personne de confiance, de participer aux décisions qui concernent sa santé ou son mode de vie et d’exprimer sa volonté avant que les troubles cognitifs ne soient trop sévères [1]. Dans l’état actuel des connaissances et avec les moyens actuels du système de santé, le dépistage systématique de la maladie d’Alzheimer ou apparentée n’est pas recommandé en population générale [2].
Une revue systématique de 59 études, 224 essais randomisés contrôlés et 3 études observationnelles [3] en vue de la mise à jour des recommandations étatsuniennes de l’USPTF, a identifié un essai randomisé comparant des patients sans manifestation significative de déficit cognitif randomisés en deux groupes pour un dépistage de démence (n= 2008) et l’absence de dépistage (n=1997).
Le dépistage reposait sur un test d’évaluation de la mémoire épisodique, le Memory Impairment Screen (MIS) équivalent du test des 5 mots, et le Mini-Cog test [4], test de dépistage bref utilisable en soins primaires et associant le test des 3 mots et le test de l’horloge. Les patients chez lesquels l’un ou l’autre de ces deux tests était positif étaient ensuite orientés pour une évaluation et confirmation du diagnostic. En cas de confirmation ils étaient ensuite pris en charge pour un programme de soins et de travail d’entretien et d’amélioration de la mémoire.
Les questionnaires de qualité de vie, Multi-Attribute Health Status Classification System (HUI 2 & HUI 3), explorent 8 items différents (la vision, l’audition, la parole, la déambulation, la dextérité, l’émotion, la cognition et la douleur) avec pour chacun 5 à 6 cœfficients. Ils sont utilisés pour l’évaluation de la santé de la population et le nombre d’années de vie potentiellement gagnées en vue de prendre des décisions concernant l’utilisation des soins de santé.
Sur une échelle de 0, 36 à 1 (1 = absence de déficit), dans le groupe dépisté le score variait de 0,67 (IC 95% 0,65-0,68) à la base, à 0,71 (0,69-0,72) à 1 mois, 0,69 (0,67-0,71) à 6 mois et 0,68 (0,66-0,69) à 12 mois.
Dans le groupe non dépisté les scores n’étaient pas significativement différents à chacune des étapes, 0,67 (0,66-0,69), 0,69 (0,68-0,71), 0,70 (0,68-0,72) et 0,68 (0,66-0,70) respectivement à la base et à 1, 6 et 12 mois.
Aucune différence n’a été retrouvée à 12 mois quant à l’utilisation des soins de santé ou la reconnaissance d’une démence par les médecins.
Il n’y a actuellement aucune preuve suffisante que le dépistage systématique des troubles cognitifs chez des personnes âgées asymptomatiques offre des avantages cliniquement importants pour les patients ou leurs soignants du fait d’une détection précoce d’une déficience cognitive [3,5,6].
Références:
[3] Patnode CD, Perdue LA, Rossom RC, et al. Screening for Cognitive Impairment in Older Adults: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA. 2020;323(8):764–785. doi:10.1001/jama.2019.22258
[5] Brayne C. Evidence Still Lacking for Recommendation of Screening for Cognitive Impairment in Older Adults. JAMA Intern Med. Published online February 25, 2020. doi:10.1001/jamainternmed.2019.7522
[6] US Preventive Services Task Force. Screening for Cognitive Impairment in Older Adults: US Preventive Services Task Force Recommendation Statement. JAMA. 2020;323(8):757–763. doi:10.1001/jama.2020.0435
Qualité de la preuve : Niveau 3
Mots clés : maladie d’Alzheimer ; dépistage [alzheimer disease ; screening].
Quelle fiabilité des principaux tests de dépistage de déficience cognitive en soins primaires ?
Les patients atteints de troubles cognitifs légers doivent être évalués et surveillés en raison de leur risque accru de progression vers la démence [1].
Le Mini-Mental State Examination (MMSE)
Le MMSE est le plus connu et le plus utilisé. Le diagnostic de démence est en principe retenu pour un score < 24/30.
Le risque relatif (RR) de démence est de 0,1 pour un score ≥ 26 et 14,4 si ≤ 20. Dans une revue de 15 études (n=12796) [2] la sensibilité et la spécificité du MMSE pour détecter une démence au seuil de 23 à 24 étaient respectivement de 0,89 (0,85-0,92) et 0,89 (0,85-0,93). Mais la précision du test pour évaluer un déficit cognitif léger (ne compromettant pas l’indépendance les personnes restant capables d’accomplir leurs tâches quotidiennes mais avec plus de temps et d’effort) était basée sur une littérature plus petite avec une variété de seuils et de grands écarts de sensibilité (0,20 à 0,93) et de spécificité (0,48 à 0,93) [3].
Dans une revue Cochrane de 11 études [1] portant sur 1569 patients souffrant de déficit cognitif léger 8 études ont évalué la concordance entre les scores initiaux au MMSE et la conversion en démence de type Alzheimer. La sensibilité du test variait de 0,27 à 0,89 et la spécificité de 0,32 à 0,90.
Le MMSE a pour principal défaut de ne pas permettre d’explorer les fonctions exécutives relatives au raisonnement, à l’organisation et la prise de décision [2].
Il n’y a pas de preuve que le MMSE, réalisé ponctuellement, puisse servir de test simple pour identifier les patients souffrant de déficit cognitif léger à risque de développer une démence de type Alzheimer. Le risque de conversion peut être mieux prédit par une évolution des scores au cours du temps que par une mesure unique [1].
Le Mini-Cog test
Il existe un nombre limité d'études évaluant la précision du Mini‐Cog pour le diagnostic de la démence dans le contexte de soins primaires.
Le Mini-Cog test est plus rapide que le MMSE. Il associe un test de mémoire épisodique et le test de la montre. Un test négatif (> 2/5) présente une VPN de 93% par rapport à un MMSE pathologique (< 24/30) [4].
Dans une revue Cochrane [2] portant sur 4 études et 1517 participants la sensibilité du Mini-Cog variait de 0,76 à 1 et la spécificité de 0,27 à 0,85 [5]. Ainsi le Mini-Cog ne réussirait pas à détecter 24% des personnes ayant une démence (faux négatifs) et 27% des patients seraient identifiés à tort comme présentant une démence (faux positifs).
Il n’y a pour le moment pas suffisamment de preuves pour recommander le recours au Mini-Cog Test pour le repérage de la démence en soins primaires [5].
Évaluation fonctionnelle
Si l’hypothèse de trouble cognitif est envisagée le retentissement fonctionnel peut être évalué à l’aide de l’échelle simplifiée des activités instrumentales de la vie quotidienne (IADL) de Lawton portant sur les quatre items les plus sensibles de la vie courante : utilisation du téléphone, utilisation des transports, prise de médicaments, gestion des finances. La nécessité d’une aide du fait de troubles cognitifs pour au moins un de ces items constitue un retentissement significatif de ces troubles sur l’activité quotidienne du patient [6]
Autres tests
Il n’y a pas d’accord professionnel concernant le choix d’autres tests à effectuer dans le cadre d’une évaluation précoce des troubles cognitifs en soins primaires :
- Tests de mémoire : épreuve de rappel des 5 mots, Memory Impairment Screen.
- Autres tests de repérage: test de fluence verbale, test de l’horloge.
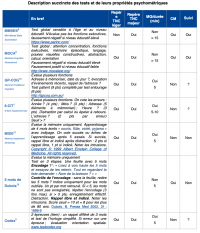
La HAS fournit une synthèse des différents tests utilisables en médecine générale (MG) ou dans le cadre de consultations mémoire (CM), de leurs propriétés psychométriques pour repérer un déficit cognitif léger ou un trouble majeur (compromettant l’indépendance avec le risque de développement d’une démence) et du temps nécessaire pour leur mise en œuvre [7].
[3] Patnode CD, Perdue LA, Rossom RC, et al. Screening for Cognitive Impairment in Older Adults: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA. 2020;323(8):764–785. doi:10.1001/jama.2019.22258
Qualité de la preuve : Niveau 3
Mots clés : maladie d’Alzheimer ; troubles cognitifs ; dépistage ; diagnostic [alzheimer disease ; cognitive impairment ; screening ; diagnosis].